REACH
Engedélyezés: frissített engedélykérelmi formátum, egyszerűsített engedélykérelem egyes tartalék alkatrészekre vonatkozóan
Az EU vegyi anyagok fenntarthatóságát célzó, közelmúltban jóváhagyott Vegyianyag Stratégiája egyszerűsítést irányoz elő az 1907/2006/EK (REACH) rendelet szerinti engedélyezés tekintetében, de már eddig is több lépés történt ebbe az irányba. Most az Európai Vegyianyag-ügynökség (ECHA) tette közzé, hogy elkészült a REACH rendelet – engedélyköteles anyagokat tartalmazó – XIV. mellékletében szereplő anyagok engedélyezési kérelmeinek benyújtásához használandó új, frissített formátum.
Ez a formátum könnyebben áttekinthető és kitölthető, és az engedélykérelmet benyújtók számára egyesíti az engedélyköteles anyagok veszélytelenebb alternatíváinak elemzését, valamint a társadalmi-gazdasági elemzést és, adott esetben, a helyettesítési tervet. Mivel kivezeti a különálló dokumentumok benyújtását, ezáltal hatékonyabbá válik a kérelmezési folyamat és koherensebbekké a benyújtott kérelmek. Mindezeken túl, frissítésre kerültek még a bizalmas kezelésre vonatkozó kérelmezői utasítások is.
A korábbi formátum felülvizsgálata az érdekelt felekkel együttműködésben valósult meg, és a kérelmezők már most meg is kezdhetik az áttérést az új formátum használatára. Mindazonáltal, ha a kérelmezők eddig már véglegesítették dokumentációjukat vagy legalábbis közel állnak kérelmük tartalmának véglegesítéséhez, az engedélykérelmek 2021 végéig még a régi formátumban is benyújthatók.
Az engedélyeztetéshez kapcsolódó további fontos tudnivaló, hogy egyszerűsített engedélykérelmek vagy felülvizsgálati jelentések nyújthatók be (50%-kal csökkentett díjak ellenében), ha az adott anyagokat az alábbiaknak megfelelően kívánják felhasználni:
- tartalék alkatrészek gyártása olyan árucikkek, összetett termékek javításához, amelyeket az adott anyag XIV. mellékletben feltüntetett lejárati időpontját követően már nem gyártanak, és amelyek gyártásához az anyagot felhasználták és azok nem működhetnek rendeltetésszerűen az említett tartalék alkatrész nélkül, valamint a tartalék alkatrész nem állítható elő ezen anyag nélkül; valamint
- olyan árucikkek vagy összetett termékek javítása, amelyeket az adott anyag XIV. mellékletben megjelölt lejárati időpontját követően már nem gyártanak, de előállításukhoz az anyagot felhasználták és kizárólag ezen anyag felhasználásával lehetséges megjavítani azokat.
Amikor ezekre a felhasználásokra vonatkozó kérelmet nyújtanak be, az alternatívák elemzése és a társadalmi-gazdasági elemzés "Az engedélyezési kérelem formátumai" menüpont alatt található speciális formátumban készítendő (ld. az alábbi linket). Mivel ilyen esetben nem áll rendelkezésre más, helyettesítő anyag, helyettesítési terv (substitution plan) összeállítása ennek megfelelően nem szükséges.
További információk
Az engedély kérelmezésének módja
Az engedélyezési kérelem formátumai
Forrás: ECHA
Új, a bőrszenzibilizáló anyagokat érintő iránymutatás segíti elő az állatkísérletek számának csökkentését
A REACH rendelet előírja a vegyi anyagokat regisztráló cégek számára, hogy in vitro módszereket (élő szervezeten kívüli, általában izolált szöveteket, szerveket vagy sejteket érintő vizsgálatok) alkalmazzanak anyagaik bőrszenzibilizáló hatására vonatkozó adatok előállításához. Az ECHA osztályozási és címkézési jegyzékében szereplő információk alapján jelenleg már több mint 14 ezer olyan anyag van az EU piacán, amely bőrszenzibilizáló hatású lehet, és az általuk előidézett allergiás kontakt dermatitisz gyakori foglalkozási és környezetegészségügyi probléma, ezért a REACH rendelet már jelenleg is számos bőrérzékenységet okozó vegyi anyagra vonatkozóan tartalmaz korlátozásokat.
A fentiekhez kapcsolódóan most új, a regisztrálók számára szóló tanácsok kerültek közzétételre arról, hogyan lehet megbízhatóan kombinálni a különböző alternatív forrásokból származó adatokat a vegyi anyagok bőrszenzibilizáló hatásának értékelése során. E tanácsok egy nemrégiben megjelent OECD-iránymutatáson alapulnak, amelynek megközelítései egyrészt annak értékelésére irányulnak, hogy egy anyag bőrszenzibilizáló-e, másrészt e hatás – REACH rendelet alapján előírt – kategorizálására, vagyis, hogy a szenzibilizáló hatás mérsékelt vagy erős-e. Az iránymutatás bemutatja, hogyan lehet ún. ’in silico’ (számítógépes szimulációs) eszközöket, például a QSAR eszköztárat (Toolboxot) használni a bőrszenzibilizációs tulajdonság értékeléséhez, ilyen módon is előmozdítva az állatkísérletek számának csökkentését. (Az OECD QSAR Toolbox egy, az OECD és az ECHA által kifejlesztett ingyenes szoftveralkalmazás, amely támogatja a reprodukálható és átlátható értékelést. Internetes elérhetőségét ld. alább.)
További információk
Tanácsok az iránymutatás használatához (Human health > Skin sensitisation menüpont)
Bőrszenzibilizáló anyagok – az ECHA vonatkozó weboldala
Forrás: ECHA
Bejelentés
A veszélyes anyagok és keverékek bejelentésével kapcsolatos 2021 első féléves tapasztalatok összefoglalása az egyes bejelentési felületekre vonatkozóan
- Országos Szakrendszeri Információs Rendszer Kémiai Biztonsági Szakrendszer (OSZIR-KBIR)
2021. január 1-jétől az OSZIR-KBIR szakrendszer veszélyes keverék menüpontjában már csak a kizárólag ipari felhasználásra szánt veszélyes keverékek bejelentését lehet megtenni, ami éreztette a hatását a benyújtott bejelentések számában is. Az év első félévében a múlt év azonos időszakához képest kevesebb, mint negyedannyi, összesen 875 bejelentés érkezett. Ezen belül a veszélyes anyagokra vonatkozóan a cégek a tavalyi hónapokhoz hasonló ütemben rögzítettek bejelentéseket.
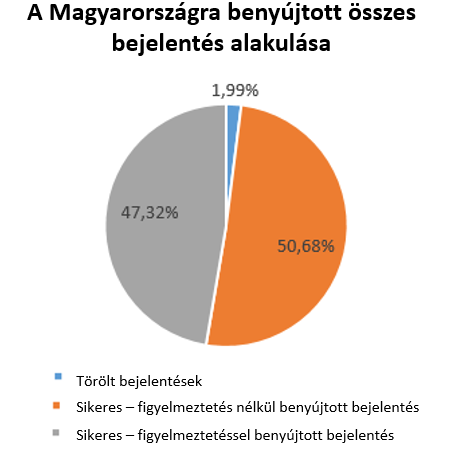
A bejelentések kétharmada az új jogszabályi előírásokkal összhangban történt, azonban egyharmadukat tévesen nyújtották be az OSZIR-KBIR szakrendszerbe, ezért azok törlésre kerültek.
|
A bejelentés törlésének oka |
Esetszám |
|
Tevékenységhez jelentett be terméket rossz helyen |
135 |
|
Foglalkozásszerű felhasználásra szánt termék |
119 |
|
Lakossági felhasználásra szánt termék |
36 |
|
Terméknév változása miatt változás bejelentés nem lehetséges |
1 |
|
Veszélyes keveréket jelentett be anyagként |
1 |
A fenti táblázatból látható, hogy a téves, ezáltal törlésre került bejelentések zömét a cégek tevékenység bejelentésének a Veszélyes anyag vagy Veszélyes keverék menüpontban történő rögzítése (46 %), valamint az anyagok és keverékek osztályozásáról, címkézéséről és csomagolásáról szóló 1272/2008/EK európai parlamenti és tanácsi rendelet (CLP) VIII. melléklete szerinti bejelentések téves felületen történő benyújtása (53%) tette ki.
A jogszabályi előírásoknak megfelelő bejelentések közül 562 került nyilvántartásba vételre, míg 21 esetben az eljárás megszüntetése vált szükségessé.
|
Az eljárás megszüntetésének oka |
Esetszám |
|
A termék a nyilvántartásban már szerepel |
11 |
|
Hiánypótló felszólításra nem válaszolt |
4 |
|
Veszélyes keverékként jelentett be a nyilvántartásban már szereplő anyagot |
3 |
|
A bejelentett keverék nem veszélyes |
1 |
|
Biocid termék engedélykérelme nincs folyamatban |
1 |
|
Az eljárás kérelemre megszüntetésre került |
1 |
Összességében elmondható, hogy 2021-ben a kezdeti hullámzó bejelentési aktivitás után a második negyedévben már a csökkenő tendencia volt jellemző. Ajánlott fokozottan figyelni arra, hogy a termékek bejelentései a felhasználási körök szerinti megfelelő bejelentési felületen kerüljenek benyújtásra:
- A kizárólag ipari felhasználásra szánt veszélyes keverékek vagy az ECHA méregközpont értesítésének portálján (PCN portál) keresztül vagy – 2023. december 31-ig – az OSZIR-KBIR szakrendszerben, a megfelelő menüpont (Veszélyes keverék) kiválasztásával rögzíthetők, a bejelentők döntése alapján.
- A lakossági- és foglalkozásszerű felhasználásra készült veszélyes keverékeket a PCN portálon keresztül kell benyújtani, ahogy arról a téves bejelentést követő törlés esetén az OSZIR-KBIR szakrendszerből automatikusan megküldött elektronikus levél is tájékoztatja az ügyfeleket.
- A veszélyes anyagokat 2021. június 29-től már nem kell bejelenteni, az ilyen bejelentések az OSZIR-KBIR szakrendszerből szintén törlésre kerülnek.
- Európai Vegyianyag-ügynökség méregközpont értesítésének portálja (PCN portál)
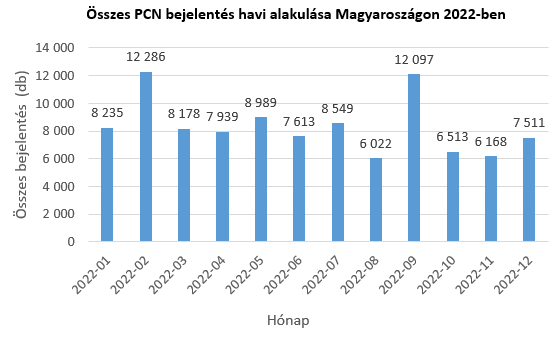
A PCN portálon keresztül 2019 májusától az első félév végéig összesen körülbelül 92 ezer bejelentést rögzítettek a cégek, ebből mintegy 60 ezer idén került a rendszerbe. A Nemzeti Népegészségügyi Központ (NNK) részéről a beérkező veszélyes keverék bejelentések feldolgozása folyamatosan történik. A bejelentések fogadásáról a PCN portál által biztosított rendszer-információn kívül az NNK további, külön tájékoztatást nem küld a bejelentő partnereknek: az adott bejelentő céggel akkor veszi csak fel a kapcsolatot, ha kérdés, pontosítás merül fel a bejelentésre vonatkozóan.
Az első félév során átnézett bejelentések alapján szerzett tapasztalatok azt mutatják, hogy a bejelentések 15-20 %-a nem felel meg a CLP rendelet VIII. mellékletében foglalt kritériumoknak.

1. Továbbra is az egyik jellemző probléma, hogy a keverék besorolása kifogásolható. Amennyiben a keverék egészségi és fizikai veszélyek tekintetében történő besorolását (veszélyességi osztály, kategória és figyelmeztető mondat) nem az I. mellékletben szereplő besorolási szabályok szerint végzik el, a segítségnyújtásnál nem megfelelő toxikológiai adatokból tud az NNK kiindulni és a címkén is hibás/félrevezető adatok szerepelnek. A toxikológiai részben meg kell adni, hogy mi alapján sorolták be a keveréket (összetevők alapján stb.).
2. A bejelentések egy részében még mindig előfordul, hogy az óvintézkedésre vonatkozó mondatok (P mondatok) nincsenek feltüntetve a címkézési elemek között, ezáltal a bejelentés hiányosnak minősül (ld. a CLP rendelet VIII. melléklete, B. rész 2.2. alpont). Fontos megemlíteni, hogy a dosszié szerkesztésekor a Kalkuláció gomb használatával a vonatkozó P mondatok megjeleníthetők.
3. Az összetevők esetében a veszélyességi kategóriák gyakran hiányoznak, vagy nem pontosan kerülnek megadásra, ami a keverék besorolásának ellenőrzését nagymértékben megnehezíti.
4. Abban az esetben, ha egy keverék egy forgalomba hozott másik keverék összetevője, akkor az első keverékre „keverékben lévő keverékként” (Mixture in Mixture; továbbiakban: MIM) történik utalás. A MIM-ben található anyagokra vonatkozó információkat a CLP rendelet VIII. mellékletének 3.2.1. alpontjában szereplő feltételek szerint kell megadni, kivéve, ha a bejelentőnek nincs hozzáférése a MIM teljes összetételére vonatkozó információkhoz (ld. 3.2.2. alpont). A legtöbb hibát az okozza, hogy a MIM-hez megadott egyedi formulaazonosítóhoz (Unique Formula Identifier; a továbbiakban: UFI) nem tartozik korábbi bejelentés a magyarországi rendszerben, ezért a pontos összetétel a magyar méregközpont számára nem ismert (ennek az információnak a forrása a beszállítóval való kommunikáció lehet), és a MIM biztonsági adatlapján szereplő összetételre vonatkozó információkat sem tüntetik fel. Fontos megjegyezni, hogy UFI hiányában a MIM szállítója nevének, e-mail címének és telefonszámának megadása kötelező.
CLP
ECHA útmutató a titán-dioxid tartalmú keverékek osztályozásáról és címkézéséről
Az ECHA útmutatót jelentetett meg a titán-dioxid tartalmú keverékek osztályozásáról. Az útmutató röviden összefoglalja a titán-dioxid és az azt tartalmazó keverékek osztályozásával kapcsolatos kérdéseket, emellett gyakorlati példákkal is segíti az érintetteket (ipari szereplők, hatóságok) az osztályozás meghatározásában.
A titán-dioxid (CAS 13463-67-7) harmonizált osztályozása – Rákkeltő hatás 2. kat., H351 (belélegzés), mely a legfeljebb 10 µm aerodinamikai átmérőjű részecskéket legalább 1%-ban tartalmazó por formára vonatkozik – 2020. február 25-től hatályos, azonban az érintett szállítóknak csak 2021. október 1-től kell azt kötelezően alkalmazniuk (lásd a cikk alatti hivatkozást a CLP rendelet 14. ATP-jére).
A titán-dioxid tartalmú keverékek osztályozásának meghatározásakor több szempontot is figyelembe kell venni, amelyeket az útmutató részletesen is tárgyal. Mivel a TiO2 rákkeltő hatása alapvetően az anyag porának belélegzése esetén jelentkezik, az osztályozás a szilárd halmazállapotú keverékeket érinti. Ezen keverékek esetében a TiO2-koncentráció és -részecskeméret mellett a keverék tényleges fizikai állapota határozza meg az osztályozás szükségességét.
Por formában forgalomba hozott keverékeknél három eset lehetséges:
- Ha a TiO2 koncentrációja a keverékben legalább 1% és ez a mennyiség a legfeljebb 10 µm aerodinamikai átmérőjű TiO2 részecskék formájában van jelen, akkor a keveréket a TiO2-tartalomra tekintettel rákkeltőként kell osztályozni és a címkén fel kell tüntetni a H351: „Feltehetően rákot okoz” figyelmeztető mondatot, amelyben meg kell adni az expozíciós útvonalat (belélegzés) is. Ezen túlmenően a címkén fel kell tüntetni az EUH212: „Figyelem! Használatkor veszélyes, belélegezhető por képződhet. Ezt a port nem szabad belélegezni.” kiegészítő figyelmeztetést is.
- Ha a TiO2 koncentrációja a keverékben legalább 1%, de a legfeljebb 10 µm aerodinamikai átmérőjű TiO2 részecskék végkoncentrációja nem éri el az 1%-ot, akkor a keveréket nem kell rákkeltőként osztályozni a TiO2-tartalomra tekintettel, de a címkén fel kell tüntetni az EUH212 (lásd fentebb) mondatot.
- Ha a TiO2 koncentrációja nem éri el az 1%-ot (függetlenül a részecskemérettől), akkor a keveréket nem kell rákkeltőként osztályozni és az EUH212 mondat feltüntetése sem szükséges.
A nem por formában (pl. tömb, pellet) forgalomba hozott, TiO2-tartalmú szilárd keverékeket nem kell rákkeltőként osztályozni, ha azonban a TiO2 koncentrációja eléri vagy meghaladja az 1%-ot (függetlenül a részecskemérettől), akkor a keverék címkéjén fel kell tüntetni az EUH212 kiegészítő figyelmeztetést.
Folyékony halmazállapotú keverékeket sem kell a TiO2-tartalomra tekintettel rákkeltőként osztályozni, abban az esetben sem, ha a TiO2 koncentrációja eléri vagy meghaladja az 1%-ot. Ugyanakkor, ha a keverék legalább 1%-ban tartalmazza a legfeljebb 10 µm aerodinamikai átmérőjű TiO2 részecskéket, akkor a címkén fel kell tüntetni az EUH211: „Figyelem! Permetezés közben veszélyes, belélegezhető cseppek képződhetnek. A permetet vagy ködöt nem szabad belélegezni.” kiegészítő figyelmeztető mondatot.
Az útmutató, amelynek kidolgozásában az ECHA mellett a német kompetens hatóság (BAuA), az Európai Bizottság és a nemzeti tájékoztató szolgálatok hálózata (HelpNet) is részt vett, további példákat is tartalmaz, például polimerekre, árucikkekre vonatkozóan.
További információk
ECHA útmutató (angol nyelven):
https://echa.europa.eu/hu/-/new-guide-available-on-classifying-and-labelling-titanium-dioxide
CLP rendelet 14. ATP konszolidált (helyesbítéseket is tartalmazó) verziója:
https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=CELEX%3A02020R0217-20200218
Forrás: ECHA
Biocidok
Biocid engedélyeztetés: az eljárás során kötelezően benyújtandó ’teljes összetétel’ megadásának lehetőségei
A biocid termékek engedélyeztetési eljárásának lefolytatásához szükséges a termék teljes és pontos összetételének ismerete, nem csak a hatóanyag, hanem a többi összetevő (anyag vagy keverék) esetében is, így minden összetevő mennyiségét szükséges megadni. Az egyes összetevők pontos mennyiségének tömegszázalékos megadása elengedhetetlen, nincs lehetőség koncentráció tartományok feltüntetésére. Ezen túlmenően az egyes alkotórészekkel, azok funkciójával, illetve reakciókeverékek esetében a biocid termék végső összetételével kapcsolatos valamennyi releváns információt is meg kell adni (például tisztaság, szennyezők stb.).
Az összetétel tekintetében feltüntetendő legfontosabb információk:
- Összetevő megnevezése (név, kémiai név, keverék esetén kereskedelmi név)
- Összetevő funkciójának megadása (pl. hatóanyag, felületaktív anyag, színezék, illat, oldószer)
- Összetevő CAS és EK száma
- Összetevő mennyisége: tömegszázalékban (m/m%) kifejezve
A hatóanyag(ok) mellett az úgynevezett ’aggodalomra okot adó anyagok’ szintén kiemelt jelentőséggel bírnak, azok külön, pontos megadása is szükséges a teljes összetételben, függetlenül attól, hogy egy, a termékhez hozzáadott keverék összetevőjeként, vagy önálló összetevőként kerülnek a termékbe.
A biocid termékek forgalmazásáról és felhasználásáról szóló Európai Parlament és a Tanács 528/2012/EU rendelet (a továbbiakban: Biocid rendelet) 3. cikk f) pontja az alábbiak szerint határozza meg az aggodalomra okot adó anyagok fogalmát:
„bármely olyan anyag, amely nem hatóanyag, és amely jellegéből fakadóan az emberekre, különösen a veszélyeztetett csoportokra, az állatokra vagy a környezetre azonnal vagy hosszabb távon ártalmas hatású, és valamely biocid termékben elegendő koncentrációban van jelen vagy képződik ahhoz, hogy adott esetben fennálljon az ilyen hatás kockázata.”
A gyakorlatban aggodalomra okot adó anyagnak tekinthető minden olyan összetevő, amely a CLP rendelet értelmében veszélyesként osztályozott vagy a veszélyesként való osztályozásra vonatkozó kritériumokat teljesíti és a biocid termékben olyan koncentrációban van jelen, amelynek következtében a termék a CLP rendelet értelmében veszélyesnek osztályozandó, továbbá a környezetben tartósan megmaradó szerves szennyező anyagok (POP) és a REACH rendelet XIII. melléklete szerint perzisztens, bioakkumulatív és mérgező (PBT) vagy nagyon perzisztens és nagyon bioakkumulatív (vPvB) anyagok.
Az engedélyezési eljárás során értékelésre kerül a teljes összetétel, azonban az engedélyokiratban, valamint annak mellékletében egészében nem jelenik meg. Az engedélyokirat melléklete főszabály szerint „A biocid termékek jellemzőinek összefoglalója” című dokumentum, amelyben az összetételre vonatkozó információknál kizárólag a hatóanyag és az aggodalomra okot adó összetevők kerülnek feltüntetésre. Korábban az engedély részeként kiadásra került a címketerv is, amelynek lényegi elemei beépítésre kerültek az előbb említett dokumentumba, kiváltva ezzel a címketervet képező mellékletet. A Biocid rendelet 69. cikke alapján, a CLP rendelet 17. és 18. cikkének kritériumaival összhangban, a címkén fel szükséges tüntetni a biocid termékek összetételét, ami a gyakorlatban azt jelenti, hogy, hasonlóan az engedély mellékletéhez, a hatóanyagot pontos mennyiséggel kell, az aggodalomra okot adó összetevőket azonban mennyiségük nélkül is elegendő feltüntetni.
Példák a különböző összetételű termékek teljes összetételének megadására:
- Keverékmentes összetétel esetén:
Ideális esetben a termék gyártója számára ismert a termék minden összetevőjének pontos mennyisége. Ilyen esetben egyszerűen megadható a teljes összetétel az alábbi – az engedélyezési eljárások keretében történő hiánypótlási felhívások esetén rendre megküldött – táblázatos formában.
|
Triviális név |
Kémiai név |
Funkció |
CAS szám |
EK szám |
Koncentráció (m/m%) |
|
A hatóanyag |
A |
hatóanyag |
XX-YY-Z |
000-000-1 |
70 |
|
B hatóanyag |
B |
hatóanyag |
YY-XX-Z |
000-000-2 |
10 |
|
Bőrvédő összetevő |
C |
Bőrvédő szer |
ZZ-XX-Y |
000-000-3 |
2 |
|
Víz |
víz |
oldószer |
7732-18-5 |
231-791-2 |
ad. 100 % |
- Keverék az összetételben:
Gyakran a termék gyártója nem rendelkezik információval az általa szándékoltan hozzáadott keverék pontos összetételéről, mert például üzleti titok esetén csak kizárólag a keverék biztonsági adatlapja alapján tájékozódhat a termékébe szándékoltan kerülő keverék pontos összetételéről. Ilyen esetben az első példának hozott táblázatban nem lehetséges megadni a termék pontos összetételét, így a táblázatot értelemszerűen át szükséges alakítani olyan módon, hogy abban minden kötelezően megadandó adat szerepeljen, így a hozzáadott keverék(ek) pontosan nem ismert összetevői is, de értelemszerűen csökkentett adattartalommal.
Megjegyzendő, hogy az engedélyezési eljárások során minden veszélyes összetevő esetében be szükséges nyújtani a vonatkozó biztonsági adatlapokat, ugyanakkor egy keverék biztonsági adatlapja ilyen esetben értelemszerűen több összetevőt is lefedhet e kötelezettség tekintetében.
a) Példa arra, ha a hatóanyag keverék formájában kerül a termékbe:
Az alábbi termék két hatóanyag premixből (10-10 m/m%), gélesítő adalékból és vízből kerül összeállításra. A gyártó számára ismert, hogy az első premix 50 m/m%, a második premix 25 m/m% hatóanyagot tartalmaz. A premixek egyéb összetevőiről a gyártónak nincs ismerete, azonban a biztonsági adatlapok alapján tudja, hogy a premixek aggodalomra okot adó összetevőt nem tartalmaznak. Ilyen esetben az alábbi módon adható meg egyszerűen a teljes összetétel.
|
Összetevő neve |
Kémiai név |
Funkció |
CAS szám |
EK szám |
Koncentráció (m/m%) |
|
|
DADA 50 hatóanyag premix |
Hatóanyag1111 |
A |
hatóanyag |
XX-YY-Z |
000-000-1 |
5 |
|
egyéb összetevők |
- |
- |
- |
- |
5 |
|
|
BABA 25 hatóanyag premix |
Hatóanyag2222 |
B |
hatóanyag |
YY-XX-Z |
000-000-2 |
2,5 |
|
egyéb összetevők |
- |
- |
- |
- |
7,5 |
|
|
Gél 100 |
Gél |
C |
gélesítő |
XY-YZ-X |
0-0-0 |
5 |
|
Víz |
oldószer |
7732-18-5 |
231-791-2 |
75 |
||
A keverékekben hozzáadott hatóanyagok tekintetében fontos megjegyezni, hogy mind a ’tiszta szesz’, mind a ’denaturált szesz’ keveréknek tekintendő, és hatóanyagként a táblázatokban csak az ’abszolút alkohol’ mennyiséget szabad feltüntetni, mint etanolt.
b) Példa aggodalomra okot adó anyagot is tartalmazó, több keverék felhasználásával előállított termék összetételének lehetséges megadására:
|
Összetevő neve |
Kémiai név |
Összetevő funkciója |
CAS szám |
EK szám |
Koncentráció (m/m%) |
|
|
A keverék |
Hatóanyag1111 |
A |
hatóanyag |
XX-YY-Z |
000-000-1 |
20 |
|
Hatóanyag2222 |
B |
hatóanyag |
YY-XX-Z |
000-000-2 |
20 |
|
|
egyéb összetevők |
- |
- |
- |
5 |
||
|
B keverék |
Hatóanyag3333 |
C |
hatóanyag |
ZZ-YY-Y |
000-000-4 |
10 |
|
Aggodalomra okot adó anyag1111 |
D |
denaturáló szer |
XXYY-XY-Z |
000-000-5 |
5 |
|
|
egyéb összetevők |
5 |
|||||
|
C komponens |
Aggodalomra okot adó anyag2222 |
E |
felületaktív anyag |
XY-YZ-X |
000-000-3 |
3 |
|
Parfüm (keverék) |
Illatanyag1111 |
F |
illatanyag |
- |
- |
5 |
|
Illatanyag2222 |
G |
illatanyag |
- |
- |
||
|
Víz |
oldószer |
7732-18-5 |
231-791-2 |
27 |
||
Fenti táblázat esetében összesen öt biztonsági adatlapot szükséges benyújtani: ’A keverék’, ’B keverék’, ’C komponens’, valamint a ’Parfüm (keverék)’-nek és magának a kész terméknek a biztonsági adatlapját.
A ’Parfüm (keverék)’ összetevő nem tartalmaz sem hatóanyagokat, sem aggodalomra okot adó anyagokat, így a ’Parfüm (keverék)’ összetevő alkotóelemeit nem szükséges pontosan megadni, elegendő a termékben lévő összes ’Parfüm (keverék)’ mennyiségének megadása.
A teljes összetételben ugyan elfogadható a biztonsági adatlapokból nem ismert „egyéb összetevők” fentiek szerinti feltüntetése, de hangsúlyozandó, hogy a forgalomba hozott termék megfelelőségéért és biztonságosságáért a teljes felelősség az engedély tulajdonosát terheli, függetlenül attól, hogy ismeri-e annak teljes, pontos összetételét vagy sem.
Kapcsolat
Cím: 1097 Budapest, Albert Flórián út 2-6.
Telefon: 06-1-476-1195
E-mail: Ez az e-mail-cím a szpemrobotok elleni védelem alatt áll. Megtekintéséhez engedélyeznie kell a JavaScript használatát.
Honlap: https://www.nnk.gov.hu/index.php/kemiai-biztonsagi-es-kompetens-hatosagi-fo/kbkhf-kezdolapja